 #Ensaios
#Ensaios
Fronteiras terapêuticas para o câncer
Novos inibidores revolucionam o tratamento oncológico, mas resistência de células tumorais requer diferentes abordagens
 Heterogeneidade do microambiente tumoral desafia resistência terapêutica de célula cancerosa | National Cancer Institute - Unsplash
Heterogeneidade do microambiente tumoral desafia resistência terapêutica de célula cancerosa | National Cancer Institute - Unsplash
O câncer está frequentemente associado à ativação desregulada de vias de sinalização celular, que impulsionam a proliferação exacerbada de células tumorais.
Nos últimos vinte anos, o desenvolvimento de inibidores farmacológicos personalizados e direcionados a essas vias revolucionou o tratamento oncológico.
Um exemplo notável é a via de sinalização celular MAPK (Mitogen-Activated Protein Kinase), que regula diferentes processos e é frequentemente alterada em tumores como melanoma e câncer colorretal, sobre a qual fármacos como vemurafenibe e cetuximabe têm demonstrado eficácia, melhorando a sobrevivência dos pacientes e controlando a progressão tumoral.
No entanto, o resultado desses tratamentos é frequentemente limitado pelo desenvolvimento de resistência do tumor.
Essa resistência surge da evolução dinâmica de populações heterogêneas de células tumorais, que interagem entre si e com o microambiente tumoral.
A heterogeneidade genética favorece a seleção de células resistentes, permitindo o surgimento de mutações secundárias que reativam as vias oncogênicas e comprometem o sucesso terapêutico.
Diante desse desafio, uma abordagem contraintuitiva surge como alternativa: seria possível induzir citotoxicidade ao aumentar a sinalização oncogênica para além do limiar tolerado pelas células tumorais? Estudos pré-clínicos sugerem que sim.
A ciência da hiperativação
A hiperativação de vias oncogênicas pode gerar um estresse celular tão intenso que se torna insustentável para a sobrevivência das células tumorais.
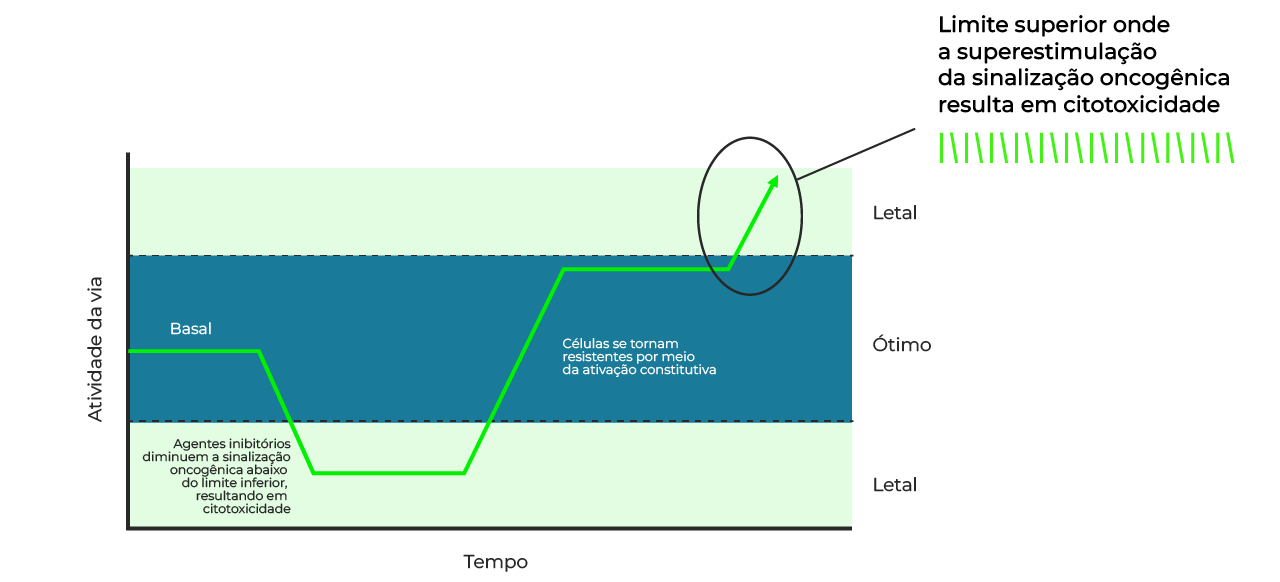
Essa estratégia baseia-se no fato de que as células tumorais mantêm a sinalização dessas vias em um nível “ótimo”, suficiente para sustentar o crescimento sem causar colapso celular.
Romper esse equilíbrio, seja por inibição ou hiperativação, expõe vulnerabilidades que podem ser exploradas terapeuticamente.
Pesquisas recentes investigam combinações de tratamentos que alternem entre inibição e hiperativação, visando atingir populações tumorais heterogêneas.
Essas estratégias têm o potencial de reduzir a carga tumoral e controlar o crescimento do câncer, mesmo em casos resistentes aos tratamentos alvo-dirigidos.
Quando as células desenvolvem resistência a inibidores, elas frequentemente compensam com uma ativação constante da via, aproximando-se de um limite superior de sinalização.
Essa adaptação, paradoxalmente, cria uma vulnerabilidade: uma hiperativação além desse limite gera estresse celular letal.
Assim, terapias que explorem um esquema de alternância entre a inibição e a hiperativação podem desestabilizar as células tumorais e induzir sua morte ou contribuir para a geração de clones resistentes menos agressivos.
Embora promissora, essa abordagem enfrenta desafios significativos. Um dos principais entraves é a falta de fármacos desenvolvidos especificamente para hiperativar vias oncogênicas.
Nas últimas décadas, o foco predominante foi o desenvolvimento de inibidores, deixando uma lacuna na pesquisa de compostos que promovam a hiperativação.
Ainda assim, essa limitação pode ser encarada como uma oportunidade.
Fármacos já aprovados em outros contextos, como proteção ou regeneração tecidual, podem ser reposicionados para essa finalidade.
Além disso, avanços na identificação e no desenvolvimento de novos compostos oferecem o potencial de criar uma nova classe de medicamentos.
Abordagem inovadora
A determinação dos limites exatos para alternar entre inibição e hiperativação permanece um campo de estudo em expansão.
Identificar esses limiares é crucial para desenvolver protocolos clínicos seguros e eficazes.
Além disso, a combinação de abordagens, incluindo reposicionamento de medicamentos e desenvolvimento de novos agentes, pode acelerar a transição dessa estratégia para ensaios clínicos.
Explorar os limites superiores e inferiores da sinalização celular não apenas desafia paradigmas existentes, mas também abre novas perspectivas para tratar cânceres resistentes, oferecendo alternativas para pacientes com poucas opções terapêuticas.
Desse modo, essa abordagem inovadora tem o potencial de aprimorar as intervenções terapêuticas para o câncer.
Julia Rezende da Silva é doutoranda do Programa de Pós-Graduação em Farmácia (Fisiopatologia e Toxicologia) da Faculdade de Ciências Farmacêuticas da Universidade de São Paulo, onde trabalha com genes envolvidos na progressão e resistência do câncer. Realizou estágio supervisionado no The Institute of Cancer Research em Londres, Reino Unido, onde estudou a hiperativação de vias oncogênicas como nova estratégia terapêutica para o câncer.
Os artigos opinativos não refletem necessariamente a visão do Science Arena e do Hospital Israelita Albert Einstein.
*
É permitida a republicação das reportagens e artigos em meios digitais de acordo com a licença Creative Commons CC-BY-NC-ND.
O texto não deve ser editado e a autoria deve ser atribuída, incluindo a fonte (Science Arena).


